Chromatographie Trennprinzipien
Chromatographie
| Einführung | Historie | chromatographische Verfahren | Trennprinzipien | Versuche |
Trennprinzipien
Gleichgewichte bei Adsorption und Verteilung
Alle chromatographischen Trennverfahren beruhen auf der unterschiedlichen Wechselwirkung (Affinität) von Stoffen zu einer stationären und einer mobilen Phase.
Die mobile Phase transportiert die in einer Probe enthaltenen Einzelkomponenten mit einer für alle Teilchen gleich großen Transportkraft durch das chromatographische System. Bei diesem Transport wechseln die Probenbestandteile sehr viele Male von der mobilen in die stationäre Phase und zurück. Dadurch werden sie im Vergleich zu Geschwindigkeit der mobilen Phase verlangsamt – und zwar umso mehr, je länger sie sich in oder an der stationären Phase aufhalten. Da diese Verweildauer bei gegebenem chromatographischen System eine spezifische Stoffeigenschaft ist, lassen sich die einzelnen Probenbestandteile räumlich und zeitlich voneinander trennen. Auf molekularer Ebene werden zwei Grundprinzipien zur Deutung der substanzspezifischen Affinitäten herangezogen: die Gleichgewichte von Adsorption und Verteilung. Nachfolgende Bilder zeigen modellhaft verschiedene Phasen einer chromatographischen Trennung:
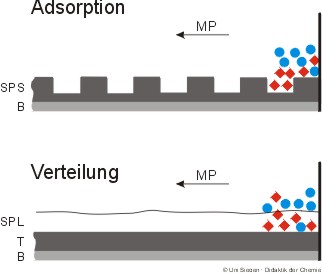
Die Substanz 1 (eckiges Symbol) hält sich durch stärkere Adsorption bevorzugt an der Oberfläche der festen stationären Phase bzw. durch bessere Löslichkeit in der flüssigen stationären Phase auf. Substanz 2 (rundes Symbol) hat eine größere Affinität zur mobilen Phase.

Nach einiger Zeit hat nachströmendes Fließmittel die in ihm gelösten Bestandteile des Gemisches an unbesetzte „freie“ Stellen der festen oder flüssigen stationären Phase transportiert. Gleichzeitig gelangt reines Fließmittel an die mit adsorbierten bzw. gelösten Teilchen belegten Orte der stationären Phase. An beiden Stellen verteilen sich die Substanzen erneut entsprechend ihrer Affinitäten zwischen den beiden Phasen

Nach vielfacher Wiederholung der Gleichgewichtseinstellungen sind die Substanzen vollständig voneinander getrennt.
Unabhängig davon, welcher der beiden unterschiedlichen molekularen Mechanismen für die unterschiedliche Verteilung der Probenbestandteile verantwortlich ist, lassen sich derartige Verteilungen zwischen zwei Phasen theoretisch durch einen Verteilungskoeffizienten K beschreiben. Der Verteilungskoeffizient ist definiert als das Verhältnis der Gleichgewichtskonzentration eines Stoffes in der stationären (sorbierenden) Phase (cs) zu der in der mobilen Phase (cm):
K = cs/cm
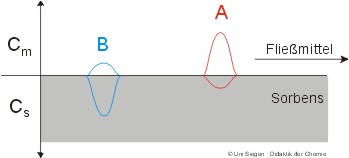
Diese Beziehung gilt für eine bestimmte Temperatur und nur für sehr kleine Stoffmengenkonzentrationen, bei denen eine Sättigung der stationären Phase (cunendlich ) nicht erreicht ist. Die graphische Darstellung der Gleichung für den Verteilungskoeffizienten führt zu Sorptionsisothermen. In einem bestimmten chromatographischen System sind zwei Stoffe A und B nur dann zu trennen, wenn sie unterschiedliche Sorptionsisothermen aufweisen:
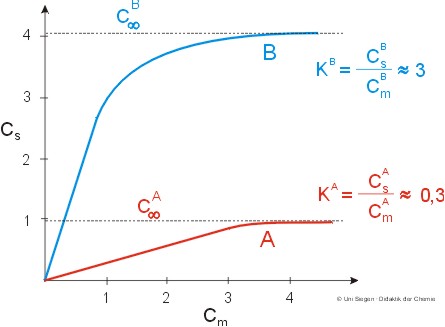
Stoff B hält sich vorwiegend in der stationären Phase auf, wodurch seine chromatographische Wanderungsgeschwindigkeit kleiner als die von Stoff A ist: